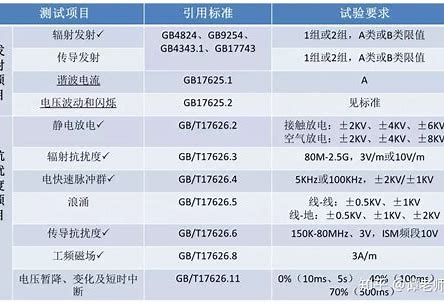
新修订《医疗器械监督管理条例》(以下简称《条例》)已于2021年6月1日起实施。《医疗器械监督管理条例》修订后,我国医疗器械复检制度发生重大变化,也迎来重大进步。
新旧比较
现行《医疗器械监督管理条例》第75条第三款规定:
当事人对检验结论有异议的,可以自收到检验结论之日起7个工作日内向实施抽样检验的部门或者其上一级负责药品监督管理的部门提出复检申请,由受理复检申请的部门在复检机构名录中随机确定复检机构进行复检。承担复检工作的医疗器械检验机构应当在国务院药品监督管理部门规定的时间内作出复检结论。复检结论为*终检验结论。复检机构与初检机构不得为同一机构;相关检验项目只有一家有资质的检验机构的,复检时应当变更承办部门或者人员。复检机构名录由国务院药品监督管理部门公布。
而修订前的《医疗器械监督管理条例》第57条第三款规定:
当事人对检验结论有异议的,可以自收到检验结论之日起7个工作日内选择有资质的医疗器械检验机构进行复检。承担复检工作的医疗器械检验机构应当在国务院食品药品监督管理部门规定的时间内作出复检结论。复检结论为*终检验结论。
五处变化
新旧《条例》相比较,医疗器械复检制度在立法层面发生五处重大变化:
1.从当事人选择检验机构复检,改为向监管部门实施抽样检验的部门或者其上一级负责药品监督管理的部门提出复检申请;
2.从当事人选择复检机构,修改为由受理复检申请的部门在复检机构名录中随机确定复检机构进行复检;
3.增加“复检机构与初检机构不得为同一机构”的规定;
4.增加“相关检验项目只有一家有资质的检验机构的,复检时应当变更承办部门或者人员”的规定;
5.明确复检机构名录由国务院药品监督管理部门公布。
制度安排
从新旧《条例》关于医疗器械复检制度规定的变化,可以明显感受到新修订《医疗器械监督管理条例》的重大进步,充分体现了更科学、更合理的制度安排。
一是检验关系更对应。复检机构由药监部门确定,与初检阶段由药监部门委托检验机构检验更加对应。
二是对复检机构的监督更有效。新《条例》实施后,检验机构要想从事复检业务,不但要取得检验资质,还要进入国家药监局的复检机构名录,两者缺一不可。如果检验机构对复检业务未能勤勉尽责,必然存在被剔除出复检机构名录的风险,监管部门对复检机构的监督更加有效。
三是复检机构的选择过程更公正。旧《条例》规定由当事人选择复检机构,自然难以避免亲疏嫌疑。而新《条例》规定由受理复检申请的部门在复检机构名录中随机确定,当事人不能自行选择复检机构,受理复检申请的监管部门也必须采取随机方式在名录中确定,*大程度上避免了人为因素,以程序公正*大程度保证复检结论的公正性。
四是回避规定更严格。“任何人不得做自己案件的法官”,复检结论是*终检验结论,复检机构完全有可能推翻初检结论。如果初检机构与复检机构是同一家机构,就必然存在利害关系,自己初检自己复检,会让社会公众对复检结论的公正性产生怀疑。同时,新《条例》在作出原则性规定时,针对相关检验项目只有一家有资质的检验机构的特殊情形,规定复检时应当变更承办部门或者人员,体现了原则性与灵活性的结合,以保障特殊情形下复检程序公正。
五是复检机构名录更统一权威。复检机构名录只能由国务院药品监管部门统一公布,可有效避免各地自行公布名录,确保复检机构名录的统一性、权威性,进入名录的复检机构也会更具责任感。
对于监管部门来说,需要特别注重确定复检机构过程中的程序合法性:一是复检机构必须已列入国家局公布的名录;二是采用随机方式确定,避免因确定复检机构过程中存在程序问题而引发争议。
《医疗器械监督管理条例》修订,医械复检制度将发生重大变化
百检网 2022-05-10
百检能给您带来哪些改变?
1、检测行业全覆盖,满足不同的检测;
2、实验室全覆盖,就近分配本地化检测;
3、工程师一对一服务,让检测更精准;
4、免费初检,初检不收取检测费用;
5、自助下单 快递免费上门取样;
6、周期短,费用低,服务周到;
7、拥有CMA、CNAS、CAL等权威资质;
8、检测报告权威有效、中国通用;
客户案例展示
相关商品
版权与免责声明
①本网注名来源于“互联网”的所有作品,版权归原作者或者来源机构所有,如果有涉及作品内容、版权等问题,请在作品发表之日起一个月内与本网联系,联系邮箱service@baijiantest.com,否则视为默认百检网有权进行转载。
②本网注名来源于“百检网”的所有作品,版权归百检网所有,未经本网授权不得转载、摘编或利用其它方式使用。想要转载本网作品,请联系:service@baijiantest.com。已获本网授权的作品,应在授权范围内使用,并注明"来源:百检网"。违者本网将追究相关法律责任。
③本网所载作品仅代表作者独立观点,不代表百检立场,用户需作出独立判断,如有异议或投诉,请联系service@baijiantest.com
相关资讯